Kockázat és biztonság az élelmiszer-gazdaságban
Fumonizin toxinok vizsgálata sertésekben
Zomborszkyné Kovács Melinda
A hazai szemestakarmányok, főleg a kukorica viszonylag nagy százaléka fertőzött Fusarium moniliforme penészgombával. E gombafaj fő toxinja a fumonizin B1, amely a tapasztalatok szerint akár toxikus dózisban is előfordulhat a sertések takarmányában és a sertések tüdővizenyője betegséget (porcine pulmonary edema, PPE) okozza.
A szfinganinhoz hasonló kémiai szerkezete révén elsősorban a szfingolipidek metabolizmusának és működésének megváltoztatása révén fejti ki káros hatását. A szfingolipidek szabályozó szerepet töltenek be többek között a sejtek növekedésében, differenciálódásában, a sejtek közötti kommunikációban, valamint a sejten belüli jelátadásban. A fumonizin B1 a szfinganin-N-aciltranszferáz gátlása révén a szfingolipid bioszintézis természetes inhibitora. Kísérletesen in vivo és in vitro igazolt, hogy a fumonizinek idő- és koncentrációfüggően károsítják a szfingolipid metabolizmust, amelynek fajonként eltérő következményei vannak: lovakban encephalomalaciát okoz és hepatotoxikus (Marasas és mtsai, 1988), sertésekben máj- és veseelfajulást, valamint tüdővizenyőt (Harrison és mtsai, 1990), patkányokban máj-, veseelfajulást és májrákot idéz elő (Gelderblom és mtsai, 1988). A sejtek homeosztázisát megzavarva sejtpusztulást, apoptózist indukál (Wang, 1996). A sejtek működésében és morfológiájában fellépő változások részben a komplex szfingolipidek hiányának, részben a citotoxikus hatású metabolitok (szfinganin) felszaporodásának köszönhetők. A fumonizin B1 toxikózis legkorábbi és legérzékenyebb indikátora a szabad szfinganin mennyiségének megemelkedése. A közelmúltban kidolgozott analitikai módszereknek köszönhetően (Shephard et al., 1996) szövet-, vizelet- és vérminták viszonylag kis mennyiségéből kimutatható a szfingolipid bioszintézis gátlásának mutatója, a szabad szfinganin és szfingozin arány (SA/SO). A módszer előnye, hogy nagyszámú minta vizsgálata viszonylag egyszerűen elvégezhető. Solfrizzom és mtsai (1997) kimutatták, hogy fumonizinnel kezelt patkányokban az SA/SO arány szignifikáns növekedését kiváltó minimálisan hatásos dózis már 1-2 m g/g. Riley és mtsai (1996) vizsgálatai alapján sertésben a SA/SO arány megemelkedése már jóval a szérum biokémiai paramétereinek, vagy a parenchymas szervek mikroszkopikus elváltozásának megjelenése előtt megfigyelhető, még igen alacsony, 5 ppm toxinhatás esetén is.
Magyarországon az 50-es évek elején tömegesen észlelték ősszel, az "új" kukorica fogyasztását követően sertésben a kóroktanilag nem tisztázott tüdővizenyő járványszerű előfordulását. A betegséget Domán és Petrás írták le 1952-ben és mint a sertések "hizlalási vagy a sajátos tüdővizenyője" vált ismertté. A betegség lefolyásának, a kialakuló klinikai tüneteknek és a kórbonctani képnek az USA-ban az 1980-as években fumonizin B1 toxikózis okaként leírt PPE való nagyfokú hasonlósága felvetette a kérdést, nem azonos kóroktanú megbetegedésekről van-e szó (Kakuk, 1995). A betegséget Fazekas és mtsai (1997) kísérleti állatetetéssel reprodukálták. Két 10-12 kg testtömegű malaccal 330 mg/takarmány kg FB1 etetését követően az állatok az 5. napra elhullottak. A mellkasban mellvízkór, a tüdőben vizenyő, májelváltozás és sárgaság, agyödéma és kezdődő körülírt agylágyulás (malacia) volt diagnosztizálható.
A sertések megbetegedését kisebb dózisban is sikerült előidézni. Irodalmi adatok szerint a gombatenyészettel szá jon át bevitt toxin sertésben kis koncentrációban (20 ppm alatt) klinikai tünetekben meg nem nyilvánuló májkárosodást okozott (Riley és mtsai, 1996), leírták a vese és hasnyálmirigy necrosist kiváltó hatását (Harrison és mtsai, 1990), míg a jellemző kórkép, a tüdőödéma csak ennél lényegesen magasabb dózissal,166 ppm (Haschek és mtsai, 1992), 175 ppm (Motelin, 1994) volt előidézhető.
A toxin pontos hatásmechanizmusa a mai napig nem tisztázott. A megismerésben egyre nagyobb hangsúlyt kapnak azok a komplex, "aktív élettani, biológiai mérőrendszerek", amelyek a szervezet károsodását már igen kis mennyiségű toxikus anyag hatására jelezni képesek. A környezeti mérgező anyagok élő szervezetre gyakorolt káros hatása ugyanis gyakran nem mutatható ki önmagában a fejlett technika eszközeivel. Ezért ezek mellett maguknak az élő szervezeteknek, illetve egyszerűsített, élő monitorozó rendszereiknek reakciói szolgáltathatnak adatokat. Nem helyettesítheti tehát önmagában a többnyire "statikus" állapotot rögzítő, műszeres, vagy más analitikai mérés az élő szervezetben fellépő, zajló káros, dinamikus élettani hatások megállapítását, legfeljebb segítheti, kiegészítheti azt (Kovács és mtsai, 1998). Különösen fontos ez a szervezet által még tolerálható, tehát morfológiai vagy funkcionális elváltozást még nem okozó határértékek meghatározása esetében.
Kísérleti munkánkban a PATE Állattenyésztési Kar egyedülálló diagnosztikai lehetőségeit kihasználva, a még tolerálható határértékek meghatározása céljából rövid ideig (4 hétig) tartó, és a fent említett irodalmi adatokhoz viszonyítottan kis dózisú (10, 20 és 40 mg/takarmány kg) toxinexpozíció hatását vizsgáltuk választott malacokban.

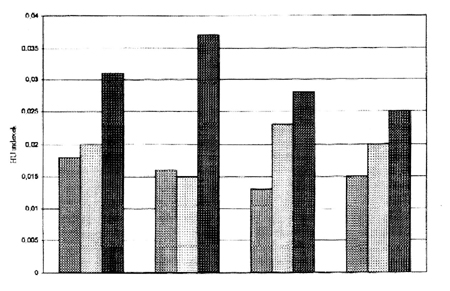
1. ábra • A választott malacok tüdőtömegének alakulása (átlag és szórás értékek
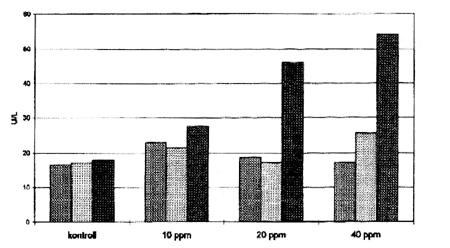
2. ábra • A plazma aszpartát aminotranszferáz (AST) aktivitásának (U/L) változása a vizsgálat 0., 14. és 28. napján

1. táblázat • A választott malacok tüdőtömegének alakulása (átlag és szórás értékek)
A 10 kg körüli testtömegű választott ártány malacok takarmányába a Debreceni Állategészségügyi Intézetben Fazekas és mtsai (1997) módszerével előállított Fusarium moniliforme gombatenyészetet kevertünk úgy, hogy a napi fumonizin B 1 bevitel 0, 10, 20 és 40 mg/takarmány kg legyen. Az állatok a kísérlet ideje alatt klinikai tüneteket nem mutattak, testtömeg-gyarapodásuk nem tért el kontroll társaikétól. Ugyanakkor a 2., és a 4. héten elvégzett számítógép tomográfos (CT) vizsgálattal enyhébb-súlyosabb fokú tüdővizenyő volt kimutatható. A röntgenképeken éles határral elkülöníthető volt az egészséges tüdőállomány az ödémás területektől.
Az elváltozások számszerűsítéséhez és statisztikai igazolásához a CT vizsgálat során kapott, és a szöveti denzitásokra jellemző Hounsfield értékekből a tüdőre vonatkoztatva ún. HU-indexeket számoltunk, majd összehasonlítottuk ezeknek az eltelt idő és az alkalmazott dózis szerinti alakulását. A tüdő víztartalmára utaló indexszámok a 40 mg/takarmány kg toxintartalmú tápot fogyasztó csoport egyedeiben a 2. illetve a 3. vizsgálati időpontra szignifikánsan emelkedtek (1. ábra). A két kisebb dózis esetében is kimutathatók voltak a változások, ezek statisztikailag nem, vagy csak 10%-os szinten voltak szignifikánsak.
Megvizsgáltuk a vérplazma egyes biokémiai paramétereinek alakulását. Ezek változása nem specifikus és általában később jelentkezik. Motelin és mtsai (1994) vizsgálatukban a 175 és a 101 ppm FB1 tartalmú tápot fogyasztó választott malacok esetében a vizsgálat 14. napján megemelkedett bilirubin és koleszterin koncentrációt, magas enzim aktivitásokat (GGT, ALT és AST) mértek. Rotter és mtsai (1996) választott malacokban a 10 ppm, takarmánnyal bevitt FB1-t fogyasztó állatok mindegyikében az aszpartát aminotranszferáz (AST) aktivitásának megemelkedését tapasztalták a kísérlet 2. hetében. Fenti eredményekhez hasonlóan kísérletünkben a biokémiai paraméterek közül a máj kóros elváltozására utalóan az aszpartát aminotranszferáz (AST) aktivitásban tapasztaltunk a dózis függvényében mindhárom kísérleti csoportban emelkedést (2. ábra).
Kísérletünk első 9 napjában megvizsgálva a fumonizin toxikózis biomarkereként számon tartott vér szabad szfinganin/szfingozin (SA/SO) arányát, mindhárom dózis esetében a toxin koncentrációjával arányos növekedést tapasztaltunk (3. ábra).
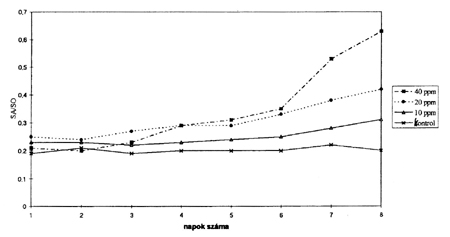
3. ábra • A szérum szabad szfinangin/szfingozin (SA/SO) arányának változása a kísérlet első napján
Boncolás során ugyancsak a dózis függvényében tapasztaltuk az elváltozás súlyosságát. Már a legkisebb toxinkoncentráció is enyhe tüdőödémát idézett elő. Míg a 10 ppm dózisnál (n=4) 3 esetben enyhébb, 20 ppm-nél (n=5) 2 állatban enyhe, kettőben súlyos fokú, addig a 40 ppm dózisnál mind az öt esetben súlyos fokú tüdővizenyőt találtunk. Jelentősen megnőtt a tüdő tömege (1. táblázat), a tüdő megnagyobbodott, tömött tapintatú volt. A tüdő teljes területén, vagy a csúcs-, szívlebenyekre és a rekeszi lebeny széli részére kiterjedően a kötőszövetes sövények jól láthatóan megszélesbedtek, utcaszerű rajzolatot mutattak (4. ábra).
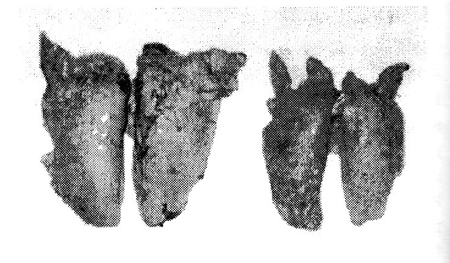
4. ábra • Egy 20 mg/takarmány kg fumonizin B1 tartalmú (kísérleti II.) és egy toxinmentes (Kontroll) tápot fogyasztó állat tüdejének képe
Kórszövettani vizsgálattal enyhébb-súlyosabb fokú subpleuralis és interiobuláris ödéma volt látható. Feltűnő volt a felületes és mély nyirokerek lymfával való telitettsége. Jellemző volt a kötőszöveti elemek közötti savós, helyenként vörösvérsejteket is tartalmazó savós beszűrődése (5. ábra). A parenchyma enyhébb mértékű károsodására utalt, hogy az alveolusok többségének üregében nem volt kóros szabad tartalom. Ez egyben magyarázatot ad a klinikai tünetek hiányára, ami feltehetően a tüdő nyirokrendszerének kompenzáló, elvezető működésének volt köszönhető.
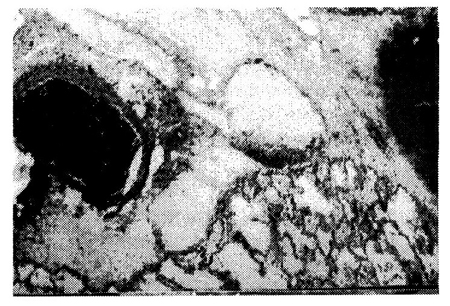
5. ábra • Egy makroszkóposan súlyos fokú tüdővizenyőt mutató állat tüdejének lórszövettani képe (hematoxilin-eozin festés, 40x-es nagyítás)
A kísérlet eredményei alapján kezdik meg a még kisebb dózissal való vizsgálatokat, amelyek célja a kimutatható elváltozást nem okozó toxinkoncentráció, a No Observed Effect Level (NOEL) meghatározása sertésben. E vizsgálatok eredményeinek részletes kiértékelése jelenleg folyamatban van. Már az alkalmazott legkisebb toxinkoncentrációval (1 ppm) is találtunk tüdővizenyőre utaló kórbonctani elváltozásokat a toxintartalmú tápot az előző kísérlethez képest hosszabb, 2 hónapig tartó etetése után.
A mikotoxinok nagy részére nincs egységesen elfogadott normarendszer. Ezért is tűzte napirendre az Európai Unió a határértékek jogi szabályozásának kérdését. A toleranciaszintek meghatározásához további referencia mérések szükségesek (Kovács és Banczerowski, 1997). A további kísérleti eredmények értékelésénél és felhasználásánál figyelembe kell venni, hogy a toxin károsító hatása annak koncentrációján túl függ a toxinbevitel módjától, a toxinhatás időtartamától (akut vagy krónikus toxin expozíció), egyéb toxinok jelenlététől (multitoxikus hatás) és még sok más tényezőtől.
A toxinoknak a perinatalis életben kifejtett károsító hatása fokozott veszélyt jelent, figyelembe véve, hogy a fiatal szervezet érzékenyebb minden fajta toxikus hatással szemben. Egyes mikotoxinok esetében bizonyított a teratogén és mutagén hatás, míg a fumonizinekre vonatkozóan nincsenek ilyen irányú eredmények. Nem ismert az sem, hogy a fumonizinek kiválasztódnak-e a tejjel, azaz a tej jelent-e potenciálisan humánegészségügyi veszélyt.
Egy kísérletünkben három, a vemhességük 107. napjában lévő kocával Fusarium moniliforme gombatenyészettel fertőzött takarmányt etettünk úgy, hogy a napi fumonizin B 1 bevitel 300 mg legyen. Ezt fogyasztották az állatok az ellésig, azaz 7 illetve 9 napig, majd két koca (1. és 2. számú) az ellést követően még további 7 napig.
Az ellés folyamatát figyelemmel kísérve, kocánként két-két malacot az ellés után azonnal, tehát még a kolosztrum kiszopása előtt megvizsgáltuk. Mind a 6 vizsgált újszülöttben enyhe, illetve súlyos fokú tüdőödémát állapítottunk meg (6. ábra).
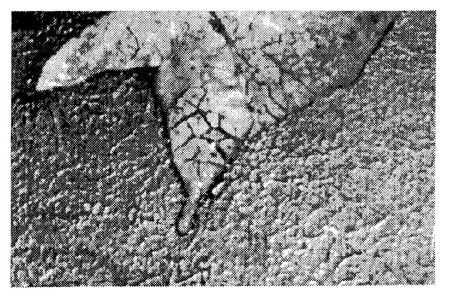
6. ábra • Megszületéskor, a kolosztrum kiszopása előtt exterminált újszülött malac kifejezett interlobuláris tüdővizenyője
A megszületést követő 24. órában ismét megvizsgáltunk hat malacot, kocánként kettőt-kettőt. Hasonlóan az előzőkhöz, enyhébb-súlyosabb elváltozások voltak láthatók. Végül a 7. napon további 6 állatot vizsgáltunk meg. Az ellést követően továbbra is toxintartalmú tápot fogyasztó két koca malacaiban enyhe tüdőödéma alakult ki, míg az ellés után toxinmentes tápot fogyasztó (3. számú) koca malacainak tüdejében nem volt látható elváltozás. A tüdőödéma kórbonctani, kórszövettani képe, jellege hasonló volt a választolt malacokban kialakult és a fentiekben ismertetett kórképhez.
A szérum szabad szfinganin/szfingozin aránya az elváltozások súlyosságával összhangban változott, a mért értékek súlyos fokú tüdőödéma esetén 0,290,36, enyhe elváltozás esetén pedig 0,20-0,24 között voltak (2. táblázat). A máj morfológiai képe a sejtosztódás zavarára utalt, aminek hátterében a szfingolipidek gátolt metabolizmusának következtében azok sejtosztódást szabályozó szerepének hiánya állhat. A máj működésének zavarát a fiziológiásnál magasabb plazma aszparaginsav transzamináz (AST), gamma glutamil transzferáz (GGT) és alkalikus foszfatáz (AKLP) aktivitás jelezte.
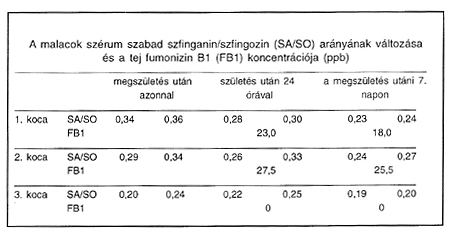
2. táblázat
Korábban nem volt ismert, hogy a fumonizin B1 vagy valamely metabolitja kiválasztódik-e a tejjel. Ellentétben Becker és mtsai (1995) megállapításával, akik vemhes kocákkal nem letális dózisú FB1 hatását vizsgálva nem találtak a tejben kimutatható mennyiségű FB1-et, kísérletünkben két koca 24. órában fejt kolosztrumában 23,0 illetve 27,5, majd a 7. napon vett tejmintájában 18,0, illetve 25,5 ppb FB1-et mutattunk ki (2. táblázat).
Az, ellést követően továbbra is toxint fogyasztó kocák malacaiban az enyhe fokú tüdővizenyőt a megszületés utáni 7. napon is megállapítottuk. Annak megválaszolása, hogy a tejjel kiválasztott toxin milyen mértékben vett részt a 7. napon tapasztalt tüdőödéma kialakulásában, további vizsgálatokat igényel.
A toxint ellés után már nem fogyasztó 3. koca tejében nem volt FB1 kimutatható, malacai a 7. napon morfológiai elváltozásoktól mentesek voltak, a szérum SA/SO értékek 0,19, illetve 0,20-ra csökkentek. Morfológiailag nem vetülő diszfunkciót jelez a még ekkor is tapasztalt magas AST, GGT és ALKP aktivitás, ami feltehetően a máj még nem tökéletes regenerációjára vezethető vissza.
A fumonizineknek a gazdasági háziállatok szaporodási folyamataira, a magzati fejlődésre gyakorolt hatása még nem ismert. Különösen fontos az alacsony dózisú, az anyaállatban klinikai tüneteket még nem okozó toxin hatásának vizsgálata és az intrauterin fejlődő magzat számára a még tolerálható értékek megállapítása.
IRODALOM
Becker, B.A., Pace, L., Rottinghaus, G.E. Shelb R., Misfetdt M, és Ross, P.F.: Effects of feeding fumonis B1 in lactating sows and their suckling pigs. American Journal of Veterinary Research, 1995. 56. 1253-1258.
Domán L: Tömeges megbetegedések hízó sertések között. Magy. Áo. Lapja. 1952. 7, 202-208.
Fazekas B., Bajmócy E., Glávits R. és Fenyvesi A.: Sertések fumonizin okozta kísérletes mikotoxikózisa. Magy. Áo. Lapja.1997. 119, 10-14.
Gelderblom, W.C.A., Jaskiewicz. K., Marasas, W.F.O., Thiel, P.G., Florak. R.M., Vleggaar, K. és Kriek. N.P.J. : Fumonisin - novel mycotoxins with cancerpromoting activity produced by Fusarium moniliforme. Appl. Environ. Microbiol. 1988. 54.1806-1811.
Harrison. L.R., Colvin. B.M., Greene Newman, L.E. és Cole. J.R: Pulmonary edema and hydrothorax in swine produced by fumonisin-B1, a toxic metabole of Fusarium monlliforme. J. Vet. Diagn. Invest. 1990. 2. 217-221.
Haschek, W.M., Motelin, G., Ness, D.K.. Harlin, K.S., Hall, WF., Vesonder, R., Peterson, R. E. és Beasley, V.R.: Characterization of fumonisin toxicity in orally and intravenously dosed swine. Mycopathologia, 1992. 117. 83-96.
Kakuk T.: A sertések sajátos hizlalási tüdővizenyőjének kóroktana napjaink mikotoxinkutatásának tükrében. Egy régi kórkép új értelmezése? Magy. Áo. Lapja. 1995. 50. 405-406.
Kovács F. Banczerowski J-né: Környezetszennyező kemikáliák és természetes toxinok. Magyar Tudomány, 1997. 8. 897-910.
Kovács F. Banczerowski J-né, Zomborszkyné Kovács M., Fazekas B.: Agrártermelés - környezetvédelem - népegészségügy: Mikotoxinok egészségkárosító hatása. Tanulmány. MTA Agrártudományok Osztálya Kiadványa, 1998. 112-161.
Marasas, W.FO., Kellerman T.S. Gelderblom. J.C.A., Coetzer, J.A.W., ThieL P.G. és van der Lught. J.J.: Leukoencephalomalacia in a horse induced by fumonisin-B1 isolated from Fusarium moniliforme. 1988. Onderstepoort J. Vet. Res. 55. 197-203.
Motelin, G.K., Haschek, W.M., Ness, D.K., Hall. W.F., Harlin. K.S., Schaeffer. D.J. és Beasley, V.R.: Temporal and dose response features in swine fed corn screenings contaminated with fumonisin mycotoxins. Mycopathology, 1994. 126. 27-40.
Petrás Gy.: Sertések fertőző tüdővizenyője. Magy. Áo. Lapja. 1952. 7. 374-378.
Riley, R.T. Wang, E., Schroeder J.J., Smith, E.R., Plattner. R.D., Abbas. H., Yoo. H.S., és Merill. A.H.: Evidence for disruption of sphingolipid metabolism as a confributing factor in the toxicity and carcinogenicity of fumonisins. Nat. Toxins, 1996. 4. 3-15.
Rotter, B.A., Thompson, B.K., Prelusky, D.B., Trenholm, H.L., Steward B., Miller. J.D. és Savard, M.F.: Response of growing swine to dietary exposure: to pure fumonisin B1 during an eight-week period: growth and clinical parameters. Nat. Toxins, 1996. 4. 42-50.
Shepard, G.S., Van der Westhuizen. L., Thiel P.G., Gelderblom, W.C., Marasas, W.F., és Van Schalkwyk. D.J.: Disruption of sphingolipid metabolism in non-human primates consuming diets of fumonisin-containing Fusarium moniliforne culture material. Toxicon. 34. 1996. 527-534.
Solfrizzom, Avantagiato. A.G., és Visconti, A.: In vivo validation of sphinganine/sphingosine rallo as a biomarker to display fumonisin ingestion. Cereal Research Communications, 25. 1997. 437-441.
Wang. W. Jones. C., Ciacci-Zanella. J., Holt, T. Gitchrist. D.G. és Dickman, M.B.: Fumonisin and Alternaria alternata lycopersici toxins: sphinganine analog mycotoxins induce apoptosis in monkey kidney cells. Proc. Natl. Acad. Sci. 1996. 93. 3461-3465.