Fizikai Szemle 2004/10. 325.o.
NANOTECHNOLÓGIA A BIOFIZIKÁBAN
Bodnár Andrea, MTA-DE Sejtbiofizikai Kutatócsoport
Damjanovich Sándor, MTA-DE Sejtbiofizikai Kutatócsoport és
DE Orvos- és Egészségtudományi Centrum, Biofizikai és Sejtbiológiai
Intézet
Vámosi György, MTA-DE Sejtbiofizikai Kutatócsoport
A nanotechnológiáról általában
A nanotechnológia manapság gyakran használt bűvös szó, amelyet csodálattal hallgatnak azok, akik nem nagyon tudják megfejteni a szó igazi jelentését. Pedig a dolog - mint az rendszerint lenni szokott - igen egyszerű, ugyanakkor nagyon hasznos fogalmak, módszerek és technikai eljárások gyűjtőnevét takarja, amelyek megértése érdekünkben áll, ha a természetet mélyebben meg akarjuk ismerni.
A legegyszerűbb és legérthetőbb meghatározás a szó jelentésére vonatkozik. A "nano" a nanométerre utal, tehát távolságot jelent: a méternek - amiről mindenkinek van fogalma - az egymilliárdod részét. Erről a hosszúságról ugyanakkor tapasztalati ismereteink természetesen nincsenek, így a valóságban elképzelni sem tudjuk, akkor sem, ha világosan értjük a szó jelentését. Azonban ha azt mondjuk, hogy az élővilág sejtjeinek alkatrészei ebbe a nagyságrendbe sorolhatóak, akkor valahogy közelebb érezzük magunkat ehhez a fogalomhoz. A csak mikroszkóppal látható baktériumok (pl. a bélcsatornánkban állandóan jelenlévő, velünk együtt élő és csak mikroszkóppal látható Escherichia coli baktérium) hossza körülbelül 1 nanométer ezerszeresének felel meg. Már ebből is látható, hogy a nanométer valóban igen kis távolság. A jelenleg legmodernebb elektron- és más mikroszkópos eljárások képesek a nanométert is "láthatóvá" tenni [1]. Gerd Binnig és Heinnch Rohrer a 80-as évek elején közölt, később Nobel-díjjal elismert képe melyet nagyon sokan megcsodálhattak - képes volt alagúteffektuson alapuló pásztázó elektronmikroszkóp segítségével az atomok - a konkrét esetben grafitkristály atomjainak - bemutatására is. Négy egymás mellé helyezett szénatom átmérője nagyjából egy nanométer távolságot jelent. Akkor miért foglalkozunk vele egyáltalán, ha ezek a kis távolságok a mi fogalmi világunkban oly keveset jelentenek?
A modern technológiák arra törekednek, hogy minél több elektronikai elemet zsúfoljanak össze a lehető legkisebb helyen. Ennek az az oka, hogy az elektronoknak a fény sebességét közelítő mozgási sebessége ellenére a mikroelektronika, a számítástechnika világában elvégzendő műveletek száma csillagászati méreteket ölt, így a legkisebb út-idő nyereség is számít. Az elektronikai egységek alapterülete évente körülbelül 1,8-szer több elemet képes befogadni. Tehát valóban létezik a műszaki fizika oldaláról közelítve olyan nanotechnológia, amelynek a szinte minden határon túli miniatürizálás, illetve azon a skálán történő technikai manipulálás a célja.
Nanotechnológia az életfolyamatok vizsgálatában
Ezek eléggé közismert tények, de mi köze van ennek a biofizikához? A nanotechnológiát a biológia "hasznosította" leghamarabb. A molekulák világában a nanométeres nagyságrend, a nanométeres világ az a természetes lépték, amelyben az életfolyamataink lejátszódnak. A molekuláris méretek biokémiai megközelítése és tanulmányozása viszonylag egyszerűnek tűnik, hiszen csak tisztán kell izolálni a biokémiailag azonosított anyagokat, és akkor a csillagászati számú, de nagyjából azonos tulajdonságú, homogén molekulapreparátum a kémia, fizika és biokémia módszereivel azonosítható és viszonylag könnyen vizsgálható. A nehézségek akkor kezdődnek, amikor a molekulák kölcsönhatásait élő sejtekben és nem összetört sejtekből kivont preparátumban kívánjuk megismerni. Az egyedi molekulák vizsgálata szinte semmi gondot nem jelent a pásztázó elektronmikroszkópia, az ugyancsak pásztázó atomerő-mikroszkópia (AFM, SFM [2]) vagy a fluoreszcenciát felhasználó pásztázó közelimező-optikai mikroszkópia (Scanning Near-Field Optical Microscopy; SNOM [3]) számára. Csomót lehet kötni a hosszú molekulákra, meg lehet próbálni eltörni a molekulát a csomók meghúzásával, és mindezt a képalkotó eljárások valamelyikével "látni" lehet. Azonban ha élő sejtek belsejében - vagy akár csak azok oly fontos külső felszínén - kívánunk a molekulák világával ismerkedni, akkor nehézségek sorával állunk szemben. A rendszert nemcsak szétszedni nem szabad, de a beavatkozás hatását is a lehető legkisebbre kell csökkenteni, ha a molekulák működését valóban háborítatlanul akarjuk megismerni. Ez az előfeltétele annak, hogy a sejtek működését a lehető legjobban megértsük és - amennyiben ennek szüksége felmerül (orvostudomány, agrártechnológiák stb.) - azt célzottan befolyásoljuk.
A nanométer nagyságrendjéhez képest a molekulák és a sejtek viszonylag nagyok. A sejtbiológiában meghatározó szerepet játszó fehérjék és nukleinsavak legtöbbször sok nm hosszúak, és természetes háromdimenziós állapotukban ugyancsak sok nm átmérőjűek. A sejtek - első közelítésben gömbök - nagyjából 5-70 mikrométer átmérője azonnal jelzi, hogy azokban nagyon sok és nagyon sokféle molekula fér el. A nanotechnológia megkísérli a fontosnak, érdekesnek ítélt molekulák egyedi tulajdonságainak, sejten belüli lelőhelyeinek, mozgásának, környezetével való kölcsönhatásainak vizsgálatát. A nanovilág és az életfolyamatok vizsgálatának célszerű összekapcsolása - például vírusok áthaladási mechanizmusának vizsgálata a sejtek membránján keresztül - teljesen új irányt indított el nemcsak a virológiában, de magában a sejtbiológiában is. Lehetővé tette, hogy megismerjük, hogyan jutnak el a molekulák a sejtek belsejében szintézisük helyéről a végső rendeltetési helyükre.
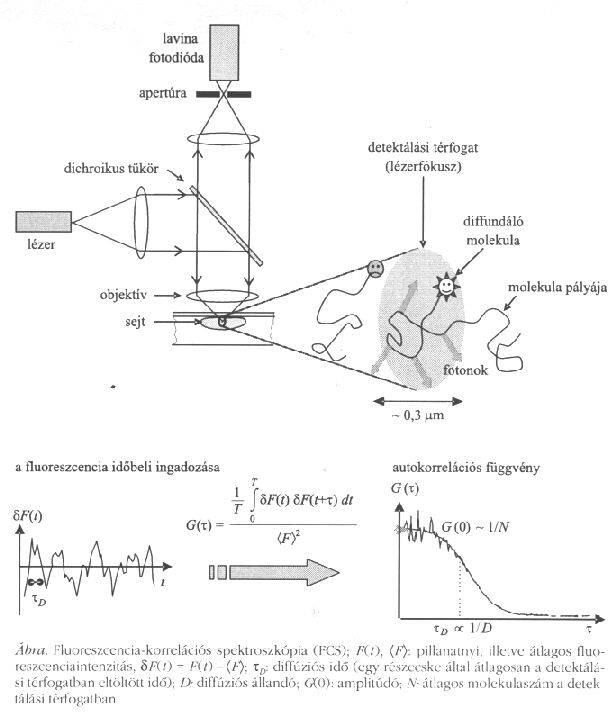
Ábra. Fluoreszcencia-korrelációs spektroszkópia (FCS); F(t), <F>: pillanatnyi, illetve átlagos fluoreszcenciaintenzitás.  F(t) = F(t) - <F>;
F(t) = F(t) - <F>;  : diffúziós idő (egy részecske által átlagosan a detektálási térfogatban eltöltött idő); D: diffuziós állandó; G(0): amplitúdó; N: átlagos molekulaszám a detektálási térfogatban
: diffúziós idő (egy részecske által átlagosan a detektálási térfogatban eltöltött idő); D: diffuziós állandó; G(0): amplitúdó; N: átlagos molekulaszám a detektálási térfogatban
Ezekhez a vizsgálatokhoz jelentős fizikai műszerezettségre és felkészültségre van szükség. A rendelkezésre álló fizikai módszerek hatékonysága lenyűgöző. Optikai csipesszel [4, 5] - ami egy kellően fókuszált rendszerint infravörös lézerfény - nemcsak egyes sejteket tudunk megragadni, felemelni és például áthelyezni vizsgálat vagy kísérlet céljából valamilyen más sejt mellé, de műanyag gömböcskék segítségével például a sejtek felszínén gyakorlatilag egyenként lehet megadott molekulafajtákat "megráncigálni", és ezzel a sejtet valamilyen működésre, válaszra késztetni, vagy éppen a molekulák közötti erőhatások nagyságát megmérni.
Az optikai spektroszkópiák a sejtek integritásának megbontása nélkül is lehetővé teszik egyedi vagy legalábbis igen kis darabszámú molekula vizsgálatát. A fluoreszcencia-korrelációs spektroszkópiában egy Fókuszált lézernyaláb a sejt valamely alkotórészének 0,1 köbmikrométernél is kisebb térfogatelemét világítja meg. Az ott gerjesztett fluoreszcencia időbeli ingadozásának sebessége az egyedi molekuláknak a megvilágított térfogatba történő be- és kidiffundálásától függ, így az intenzitásgörbe időfüggésének-, illetve célszerűbben az abból képzett autokorrelációs függvénynek - a kiértékelése a fluoreszkáló molekula mozgékonyságáról, lokális diffúziós állandójáról ad információt (ábra). A mozgékonyságból pedig a környező molekulákkal, sejtalkotókkal - például a sejt vázát alkotó citoszkeletonnal - kialakított kölcsönhatásokra vagy a több makromolekulából kialakult együtt mozgó molekulakomplex méretére következtethetünk. A keresztkorrelációs függvény alkalmazásával és különböző színűre jelölt molekulákkal pedig nem csupán azt lehet megmondani, hogy melyik molekula mellett milyen más molekulafajta található nanométeres távolságon belül, de azt is, hogy "ki kivel", melyik molekula melyik más molekulával mozog együtt f6]. Ezt a módszert még a hetvenes évek elején fejlesztették ki kémiai reakciók vizsgálatára, és folyadék közegben vizsgálták különböző molekulák koncentrációját és diffúziós mozgását [7, 8]. A mai értelemben vett nanotechnológiai módszerré a biofizika alakította azáltal, hogy a konfokális mikroszkópiával párosítva sejtszintű vizsgálatokra is alkalmassá tette, nagy szolgálatot téve ezzel a sejtbiológiának [9, 10].
A megfelelően megválasztott, különböző színű fluoreszkáló molekulák a rezonancia-energiatranszfer [11] segítségével molekulapárok közötti távolságmérésre alkalmazhatók nanométeres pontossággal. Ezt az teszi lehetővé, hogy a fluoreszkáló festékmolekulák között Fellépő, dipól-dipól kölcsönhatáson alapuló sugárzásmentes energiaátadás - rezonancia-energiatranszfer - hatásfoka távolságfüggő. Ha ezt a mérőmódszert a jobb statisztika kedvéért azonos típusú sejtek nagy sokaságán akarjuk kiválasztott molekulapárok között elvégezni, akkor az áramlási citometriával kombinálva másodpercenként akár több száz sejtről gyűjthetünk pontos adatokat a bennük található molekulák fajtáiról, távolsági paramétereiről [12-15], vagy - kihasználva az optikai anizotrópia lehetőségeit - azok mozgékonyságáról is [16]. Ezek a módszerek ma már alkalmazhatók a klinikai laboratóriumi diagnosztikában is, bár az érdeklődés az ilyen irányú vizsgálatok iránt még sajnálatosan kicsi.
Az atomerő-mikroszkópiát már említettük mint olyan módszert, amely a molekulák méreteire, eloszlására szolgáltathat adatokat az élettanihoz közeli, "nedves" állapotban, az életfolyamatokhoz szükséges vizes pufferoldatban is (tehát nem az elektronmikroszkópia által megkövetelt nagyvákuumban!) [17, 18]. Ha a nanoméretű tű mechanikai letapogatása nem biztosít elégséges felbontást a molekulafajta felismeréséhez, a fluoreszcencia is segítségül hívható a közelimező-optikai mikroszkópiában (SNOM). Ennek a felbontása nem olyan jó, mint az előbb említett atomerő-mikroszkópiáé, de a vizsgált anyagok azonosítását a fluoreszkáló jelzőanyagok (pl. az immunológiából ismert specifikusan kötődő ellenanyagok) lehetővé teszik. A SNOM - amelyet több helyen szinte egyszerre vezettek be 1987 körül - azon az elven alapszik, hogy ha a hullámhossznál kisebb átmérőjű, hegyes optikai szálon lép ki például Látható fény, akkor a tűtől néhány nanométerre lévő mintából a hullámhossznál kisebb felületet világít csak meg. A megvilágított felületen elhelyezkedő, fluoreszkáló jelzőanyagokkal ellátott molekulák eloszlásáról, topográfiájáról az Abbe-elvből következő "hagyományos" optikai felbontóképességnél sokkal jobb felbontással kapunk információt [19, 20]. Két- vagy többfotonos gerjesztéssel - megfelelő impulzuslézerek alkalmazásával - még tovább javítható a feloldás.
Új utak - új lehetőségek
Új fejezet nyílik napjainkban a nanotechnológiában a kvantum- vagy mikropontok bevezetésével. A fizikai nanotechnológia ma már minden nehézség nélkül elő tud állítani adott, néhány (5-10-20) nm átmérőjű félvezető elemeket. Ezek a például CdSe és ZnS alapanyagból készült chipek megvilágítás hatására fényt bocsátanak ki. Ez eddig nem sok újat mond, mivel a fluoreszcencia segítségével ezt már régen meg tudjuk tenni. A mikropontok óriási előnye a festékekkel vagy akár a természetes fluoreszkáló anyagokkal szemben az, hogy igen széles abszorpciós spektrummal, ugyanakkor a mikropont méretétől függő hullámhossz maximumú, igen keskeny sávú emissziós spektrummal rendelkeznek. Ez lehetővé teszi olyan megoldások alkalmazását a gyakorlatban, hogy különböző átmérőjű mikropontokkal specifikusan jelzett molekulafajták egyetlen gerjesztő fénysugár hatására az emissziós hullámok különböző színével jelzik a különböző molekulák együttes jelenlétét [21]. További előnye még ennek az optikai rendszernek, hogy a többszöri gerjesztés nem teszi tönkre, nem "égeti ki" az emittáló egységeket, így a megfigyelés időtartamának, illetve a gerjesztő fény intenzitásának nincs olyan szigorú korlátja, mint a hagyományos festékmolekulák alkalmazásakor. Ez olyan korábban kivitelezhetetlennek tűnő vizsgálatok elvégzését is lehetővé teszi, mint például egyetlen "hírvivő" (pl. hormon) molekula útjának nyomon követését a sejtbe történő belépéstől kezdve a felhasználás helyéig [22]. Természetesen ennek a már minden szempontból nanotechnológiai rendszernek is vannak hátrányai és alkalmazási problémái. A különböző átmérőjű mikropontokat el kell juttatni a megfelelő célmolekulákhoz és oda kell erősíteni azokhoz (és csak azokhoz). Ez nem mindig egyszerű folyamat, de végső fokon ez a nehézség a sokkal előnytelenebb tulajdonságokkal rendelkező egyéb fluoreszcenciás rendszerek esetében is jelentkezik.
A biofizikai-biológiai nanotechnológia ismer olyan megoldást is, amely kiválasztott fehérjék génjeinek manipulálása révén egy, a tengeri élővilágban felfedezett, úgynevezett zöld fluoreszkáló fehérjét köt az adott fehérjékhez, és azok anyagcsereútjait a sejtekben láthatóvá teszi a fluoreszkáló zöld szín. Mivel ennek a zölden fluoreszkáló proteinnek (Green Fluorescent Protein, GFP) a színe a benne előforduló aminosavak kicsiny hányadának a kölcsönhatásától függ, ugyancsak genetikai manipuláció segítségével az eredetileg zöld színt szinte tetszőlegesen Lehet más színre változtatni. Ezeknek a jelöléseknek az a hátránya, hogy a genetikai manipuláció önmagában is okozhat olyan változásokat, amelyek a megfigyelendő folyamatokat torzítják.
Széles körben ismert, hogy úgynevezett DNS-chipek segítségével nukleinsavakat, vagy hasonló elven más molekulákat, például fehérjéket lehet specifikusan azonosítani. Ennek alapja a makromolekulák komplementer felszínei közötti nagy specificitású felismerési folyamat. Egy néhány milliméter átmérőjű lapkára több tízezer különféle molekula templátja vihető fel, lehetővé téve ennyiféle molekula egyidejű kimutatását és mennyiségi analízisét. Ezeknek a módszereknek a humán genom (az emberi génállomány) analízisében, betegségek genetikai hátterének feltárásában [23], a gyógyszerhatóanyagok kifejlesztésében és kipróbálásában [24] stb. igen nagy szerepe volt és van.
A biológia és társtudományainak vizsgálómódszerei a mikroszkóp feltalálásától kezdve sokat profitáltak a fizika és a technika fejlődéséből. A fenti példák azt szemléltetik, hogy a nanotechnológiai módszerek bevezetése már most új fejezeteket nyitott az élettudományok fejlődésében.
Irodalom
1. G. BINNIG, H. ROHRER - Helv. Phys. Acta 55 (1982) 726
2. A. ASHKIN - Proc. Natl. Acad Sci. USA 94 (1997) 4853
3. P. GALAJDA, P. ORMOS - Appl. Phys. Lett.. 80 (2002) 4653
4. P. SCHWILLE, F.J. MEYER-ALMES, R. RIGLER - Biophys. J. 72 (1997) 1878
5. E.L. ELSON, D. MAGDE:-Biopolymers 13 (1974) 1
6. D. MAGDE, E.L. ELSON, W.W. WEBB -Biopolymers 13 (1974) 29
7. M. EIGEN, R. RIGLER - Proc. Natl. Acad. Sci. USA 97 (1994) 5740
8. R. BROCK, G. VÁMOSI, G. VEREB et al. - Proc. Natl. Acad. Sci. USA 96 (1999)10123
9. T. FÖRSTER - Ann. Phys. 2 (1948) 55
10. L. TRON, J. SZÖLLÖSI, S. DAMJANOVICH et al. - Biophys. J. 45 (1984) 939
11. S. DAMJANOVICH, R. GÁSPÁR JR., C. PIERI - Q. Rev. Biophys. ,30 (1997) 67
12. S. DAMJANOVICH, L. BENE, J. MATKÓ et al. - Proc. Natl. Acid. Sci. USA 94 (1997) 13134
13. Z. SEBESTYÉN, P. NAGY, G. HORVÁTH et al. - Cytometry 48 (2002) 124
14. L. BENE, M.J. FULWYLER, S. DAMJANOVICH - Cytometry 40 (2000) 292
15. G. BINNIG, C.F. QUATE, C. GERBER - Phys. Rev. Lett. 56 (1986) 930
16. S. DAMJANOVICH, G. VEREB, A. SCHAFER et al. - Proc. Natl. Acad. Sci. USA 92 (1995) 1122
17. A. JENEI, S. VARGA, L. BENE, et al. - Proc. Nall. Acad. Sci. USA 94 (1997) 7269
18. E. BETZIG, J.K. TRAUTMAN - Science 257 (1992) 189
19. P. NAGY, A. JENEI, A.K. KIRSCH et al. - J. Cell. Sci. 112 (Pt 11) (1999) 1733
20. P. NAGY, L. MATYUS, A. JENEI et al. - J. Cell Sci. 114 (2001 ) 4063
21. T.D. LACOSTE, X. MICHALET, P. PINAUD et al. - Proc. Natl. Acad. Sci. USA 97 (2000) 9461
22. D.S. LIDKE, P. NAGY, R. HEINTZMANN et al. - Nat. Biotechnol. 2004.
23. P. LIANG, A.B. PARDEE - Nat. Rev. Cancer 3 (2003) 869
24. G. SAUTER, R. SIMON, K. HILLAN - Nat. Rev. Drug Discov. 2 (2003)
962

![]() F(t) = F(t) - <F>;
F(t) = F(t) - <F>; ![]() : diffúziós idő (egy részecske által átlagosan a detektálási térfogatban eltöltött idő); D: diffuziós állandó; G(0): amplitúdó; N: átlagos molekulaszám a detektálási térfogatban
: diffúziós idő (egy részecske által átlagosan a detektálási térfogatban eltöltött idő); D: diffuziós állandó; G(0): amplitúdó; N: átlagos molekulaszám a detektálási térfogatban